A Molécula
Autor: Paulo Cesar Naoum |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A
molécula de hemoglobina é estruturalmente composta
por duas globinas do tipo alfa e duas do tipo beta, compondo um
tetrâmero com formato globular (figura 3.14). As dimensões
espaciais do tetrâmero são as mesmas nas hemoglobinas
embrionárias (Gower-1, Gower-2 e Portland), e nas hemoglobinas
Fetal, A e A2, com diâmetro de aproximadamente 5,5nm configurando-lhes
um modelo globular e discretamente achatado. O peso molecular das
hemoglobinas humanas é próximo de 64.500 daltons,
com pequenas variações entre os diferentes tipos.
Todas as moléculas de hemoglobinas das fases embrionária,
fetal e pós-nascimento têm 574 aminoácidos,
dos quais 282 estão na composição das duas
globinas tipo alfa (141 aminoácidos por globina tipo alfa)
e 292 na composição das duas globinas tipo beta (146
aminoácidos por globina tipo beta). Os graus de semelhanças
estruturais, calculado com base na similaridade da composição
de aminoácidos entre os tipos de globina são variáveis
com maior identidade entre as globinas beta e delta (96% de semelhança),
seguida da beta e gama (71%), e com menores similitudes entre alfa
e beta (42%), e alfa e gama (39%). Essa identidade química
é possível ser explicada por meio da suposição
genética sobre a origem e evolução da hemoglobina,
apresentada no início desta página. A estabilidade das moléculas de hemoglobinas, quer sejam embrionárias, Fetal, A ou A2, é dependente do arranjo estrutural que ocorre entre a composição das globinas do tipo alfa com as do tipo beta. As estruturas tridimensionais desses dois grupos de globinas são muito parecidas, apesar de suas seqüências de aminoácidos serem diferentes, conforme apresentado acima. A conformação globular da molécula de hemoglobina se deve à extensa disposição helicoidal dos polipeptídeos que compõe as globinas dos tipos alfa e beta (figura 3.15), que representa 75% do total da sua estrutura. Os trabalhos realizados por Perutz e Kendrew em 1959 utilizando o método de cristalografia de proteínas por meio da difração de raio-X, mostraram algumas particularidades físico-químicas da molécula de hemoglobina definitiva ou adulta (Hb A). A Hb A possui um rearranjo tetraédrico devido a conformação pareada de duas globinas alfa (a 2) e duas beta (b 2). Essa disposição tetramérica a 2 b 2 somente é possível devido às ligações físico-químicas de diferentes intensidades que possibilitam a movimentação da molécula durante a oxigenação. Para tornar mais fácil o entendimento dessas ligações e das suas relações com a fisiologia da hemoglobina, denominou-se o tetrâmero químico a 2 b 2 em a 1 a 2 / b 1 b 2 (figura 3.15), devido aos contatos intermoleculares que ocorrem entre globinas alfa e beta. Pela disposição do tetrâmero da hemoglobina observa-se que as globinas alfa e beta se situam diagonalmente, de tal forma que os contatos entre os aminoácidos da globina a 1 com a globina b 2 (a 1 b 2) são iguais aos que ocorrem entre as globinas a 2 b 1. Da mesma forma os contatos intermoleculares entre a 1 b 1 são iguais aos a 2 b 2. Os contatos entre as globinas a 1 b 2 e a 2 b 1 envolvem um total de 38 aminoácidos (6,6% do total de aminoácidos da molécula). Esses contatos a1 b 2 e a 2 b 1, que se dispõe na vertical do modelo molecular da figura 3.15, promovem movimentos de deslizamento das globinas alfa e beta, fato que facilita a oxigenação dos quatro grupos heme da molécula. Os contatos intermoleculares entre as globinas a 1 b 1 e a 2 b 2 são mais extensos pois participam 68 aminoácidos (11,8% do total de aminoácidos da molécula) que se dispõe na horizontal do modelo molecular da figura 3.15. Esses contatos a 1 b 1 e a 2 b 2 são os que mantém a integridade físico-química do tetrâmero, dando-lhe estabilidade molecular. Os contatos a 1 a 2 ocorrem somente na forma desoxigenada da hemoglobina, e tem influência na interação entre os grupos heme, no efeito Bohr e no transporte de CO2. Os contatos b 1 b 2 ocorrem nas formas oxi e desoxigenadas, e são responsáveis pela acomodação da molécula de 2,3 difosfoglicerato (2,3 DPG) durante a desoxigenação da hemoglobina. Os estudos seqüentes sobre a configuração estrutural da molécula de hemoglobina demonstraram que as globinas dos tipos alfa e beta tem duas regiões específicas, a interna e a externa. As regiões internas são compostas por aminoácidos não-polares e hidrofóbicos localizados em 75% da molécula, incluindo os helicóides e o grupo de aminoácidos que envolvem o grupo heme. As regiões externas são bem menos extensas, pois compreendem apenas 25% do conteúdo molecular, e são formadas por aminoácidos polares e hidrofílicos que se dispõe nas partes não helicoidais da molécula, fazendo contato com a água. A tabela 3.2 mostra os aminoácidos hidrofóbicos e hidrofílicos. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
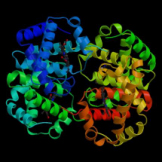
Figura – 3.14 – Modelo espacial do tetrâmero da molécula de hemoglobina formado por duas globinas do tipo alfa e duas do tipo beta, com o grupo heme inserido em cada uma das globinas. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
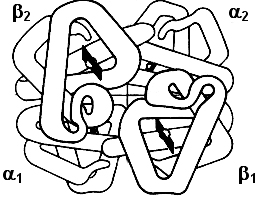 Figura 3.15 – Contatos intermoleculares entre as globinas alfa e beta. Os contatos a1 b1 e a2 b2 têm importância na estabilidade da molécula. Os contatos a1 b2 e a2 b1 atuam na movimentação da molécula durante a oxigenação. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabela 3.2 – Relação dos aminoácidos com características bioquímicas e genéticas (tríplices bases nitrogenadas). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||