Técnicas
Laboratorias de Identificação de Hemoglobinas Normais
e Variantes
Preparação de Soluções de Hemoglobinas
(Hemolisados) |
| |
Autor: Paulo Cesar Naoum
|
Introdução
Os hemolisados para eletroforese de hemoglobinas
podem ser feitos por meio do uso de saponina a 1% (100m
l de sangue total e 100m l de
saponina) ou pelo tratamento com clorofórmio. O uso de clorofórmio
destrói a Hb H e Hb Instáveis, porém é
usado para a dosagem de Hb Fetal.
Preparação do hemolisado
com clorofórmio – a obtenção
de hemolisado entre 10 e 15g/dL de hemoglobina, tal qual o método
descrito a seguir, é importante para dosagem de Hb Fetal.
Para eletroforese qualitativa de hemoglobinas é aconselhável
usar hemolisados com concentrações de hemoglobina
variáveis entre 4 a 6g/dL. A técnica de preparação
de hemolisados consiste das seguintes fases:
1. Centrifugar 1ml de sangue com anticoagulante
a 1.500rpm, durante 5 minutos; remover o plasma e lavar os eritrócitos
por duas a três vezes com solução salina a 0,85%.
Centrifugar outra vez nas mesmas condições e desprezar
o sobrenadante.
2. Ao volume de eritrócitos lavados, adicionar outro de água
destilada. Homogeneizar, e a seguir adicionar um volume de clorofórmio,
idêntico ao do hemolisado formado. Agitar vigorosamente e
centrifugar a 2.000rpm, por 15 minutos.
A solução de hemoglobina sobrenadante, ou hemolisado,
é retirada por meio de pipeta Pasteur e transferida para
um frasco limpo. A concentração do hemolisado, preparado
conforme metodologia apresentada, geralmente é variável
entre 10 e 15g/dL.
Preparação de hemolisados
rápidos – esse procedimento técnico
é recomendável para estudo populacional, nas suspeitas
de hemoglobinas instáveis e talassemia alfa. Não é
aconselhável utilizá-lo para dosagens bioquímicas
de hemoglobinas, especialmente de Hb Fetal.
Reativo hemolisante
Saponina P.A. ....................... 1g
Água destilada ...................... 100ml
Procedimento
a) para amostras de sangue com
hematócrito acima de 40%, misturar 1 volume de sangue com
2 volumes de reativo hemolisante;
b) para amostras de sangue com hematócrito
entre 30 e 40%, misturar 1 volume de sangue com 1 volume de reativo
hemolisante;
c) para amostras de sangue com hematócrito
abaixo de 30%, misturar 2 volumes de sangue com 1 volume de reativo
hemolisante.
A homogeneização deve se processar
até a hemólise completa da mistura. Utilizar o hemolisado
após 5 minutos, e no máximo 24 horas depois da sua
preparação. |
1- Eletroforese Quantitativa em Acetato de Celulose pH 8,0
- 9,0
Princípio
Em pH 8,0 – 9,0 a hemoglobina é uma
proteína carregada negativamente, migrando em direção
ao pólo positivo. Esse método identifica as hemoglobinas
normais e grande parte das variantes. As diferentes mobilidades
verificadas entre as diversas hemoglobinas com defeitos estruturais
se devem às alterações de cargas elétricas,
causadas por substituições de aminoácidos de
diferentes pontos isoelétricos (pI). As hemoglobinas que
não envolvem alterações de cargas elétricas,
geralmente apresentam mobilidade eletroforética semelhante
à da Hb A; nesse grupo situa-se a maioria das hemoglobinas
instáveis.
Equipamento
1. Cuba de eletroforese
2. Tiras de acetato de celulose
3. Papel absorvente
4. Aplicador de amostras
Reagentes
1. solução tampão: Tris-EDTA-borato
0,025M pH 8,5 (TEB pH 8,5)
Tris-hidroximetil-aminometano............................10,2g
Ácido etileno-diamino-tetracético........................
0,6g
Ácido bórico.........................................................
3,2g
Água destilada q.s.p.........................................1000ml
Procedimento
1. Colocar igual quantidade de solução
tampão em cada compartimento eletrolítico da cuba
de eletroforese;
2. Embeber o acetato de celulose na solução tampão,
previamente colocada numa vasilha, pelo menos durante 15 minutos;
3. Enxugar o acetato de celulose entre duas folhas de papel absorvente
para remover o excesso de solução tampão;
4. Ajustar as tiras de acetato de celulose na cuba de eletroforese,
deixando-as esticadas, utilizando-se de perfex ou papel de filtro
para fazer a ponte de corrente elétrica na fita;
5. Aplicar as amostras nas tiras de acetato de celulose (hemolisado
com saponina 1%, ou solução de hemoglobina) a 2 cm
do compartimento do pólo negativo;
6. Passar 300 volts por 20 minutos;
7. Analisar o fracionamento, durante os 5 primeiros minutos, observando
a presença ou não de Hb H. A Hb H, quando presente,
somente é possível de ser visualizada em hemolisados
feitos com saponina a 1%.
Controle
Durante a eletroforese é importante o uso
de, pelo menos, uma amostra controle. Na ausência de padrões
tipo Hb AS, Hb AC, ou outra forma de hemoglobina variante, usa-se
uma amostra com hemoglobina normal. O padrão normal constitui-se
num excelente meio de comparação entre hemoglobinas
“normais” e “anormais”. A utilização
de “mapas” de referência é muito útil
na interpretação dos resultados. Consulte o capítulo
5 (Listagem das hemoglobinas variantes) deste site.
Precauções
Para o uso de qualquer eletroforese são
fundamentais os seguintes cuidados:
1. Verificar se as luvas de mãos, a cuba de eletroforese,
as tiras de acetato, o aplicador e o papel absorvente estão
limpos;
2. Observar se a solução tampão não
está contaminada por colônias de fungos;
3. A solução tampão, usada continuamente, é
suficiente para oito a dez procedimentos seguidos. Porém,
no uso esporádico, por exemplo, uma vez por semana, é
interessante conservar a cuba com tampão na geladeira;
4. A obtenção de fracionamento deficiente pode ser
causada por:
a) solução tampão deteriorada;
b) alteração do pH do tampão;
c) alta molaridade do tampão;
d) corrente elétrica deficiente;
e) má qualidade do acetato de celulose;
f) excesso ou deficiência da amostra aplicada. |
2- Dosagem de Hb A2 por Eletroforese de Acetato
de Celulose pH 8,0 - 9,0
Utilizam-se os mesmos equipamentos, reagentes, e procedimentos
da técnica anterior.
Procedimento específico
a) Aplicar 20m l da
solução de hemoglobina, numa única tira de
acetato de celulose, com 4,5 a 5,5 cm de largura. Para acetato de
celulose com 2,5 cm de largura usar duas tiras, depositando 10m
l em cada uma delas;
b) Passar 300 volts durante 20 minutos;
c) Após o fracionamento, as hemoglobinas
A e A2, são recortadas com tesoura, e eluídas
em tubos contendo água destilada, na quantidade de 3 ml (para
a Hb A2) e 9 ml (para a Hb A). Deixar a eluição
se processar por 2 horas à temperatura ambiente, homogeneizando
por inversão os tubos a cada 15 minutos. Nas eluições
superiores a 2 horas, conservar o material sob refrigeração.
d) Usar água destilada como branco, e fazer
a leitura em espectrofotômetro, a 410 nm;
e) Cálculo:
% Hb A2=
|
DO A2 X 100 |
| ______________ |
| DO A X 3 + DO A2 |
VR: 2,0 à 4,0% |
3- Eletroforese em Ágar pH 6,2
Princípio
O emprego da eletroforese em ágar pH 6,2
é específico para diferenciar alguns tipos de hemoglobinas
mais lentas do que a Hb A, quais sejam: Hb S da Hb D e Hb C da Hb
E, que migram em posições similares em eletroforeses
alcalinas. Por essa técnica as hemoglbinas S e C separam-se
da Hb A, enquanto as hemoglobinas D e E migram nas mesma posição
da hemoglobina A. Esse sistema de fracionamento propicia, também,
a quantificação de Hb Fetal.
Equipamento
1. cuba de eletroforese e fonte geradora de voltagem
2. papel de filtro
3. aplicador de amostra (lamínula ou lâmina de barbear)
4. erlenmayer de 200 a 250 ml
5. lâmina de microscópio
6. pipetas de 10 ml
Reagentes
1. solução tampão fosfato
pH 6,2
Na2HPO4 ..............................................................
2,02g
NaH2PO4 . H2O .....................................................
0,6g
Água destilada q.s.p..............................................1000ml
Esta solução será usada nos compartimentos
eletrolíticos bem com na preparação do gel
de agar.
2. bacto-ágar (Difco Lab.)
Procedimento
1. colocar no erlenmayer 200mg de agar e dissolve-los
em 20ml do tampão fosfato, levando-o ao fogo e agitando-o
rotatoriamente a cada 10 minutos, até a completa dissolução
do agar;
2. pipetar 3,5ml do gel liquefeito em cada lâmina. Esse procedimento
dever ser realizado cuidadosamente: coloca-se a pipeta verticalmente
na porção média da lâmina, e deixa-se
que o gel se escoe lentamente por toda a extensão da lâmina,
até completar o volume 3,5ml, deixar por 10 a 15 minutos
em repouso;
3. aplicar as amostras (solução de hemoglobina, ou
hemolisado com saponina) na porção média da
lâmina. Para isso usa-se pedaço de lamínula,
ou de lâmina de barbear (tipo Gillette), molhado em sua extremidade
com a amostra a ser analisada. A aplicação se faz
introduzindo verticalmente o aplicador no gel, observando-se o cuidado
de não atingir a lâmina;
4. colocar a lâmina na cuba de eletroforese, e conectar suas
extremidades com os respectivos compartimentos eletrolíticos
por meio de “pontes” realizadas com duplo papel de filtro;
5. passar 100 a 150 volts por 20 a 15 minutos, respectivamente;
6. analisar o fracionamento, inicialmente sem corar;
7. remover a lâmina e corar com Ponceau S (ou outro corante
de proteínas) por 20 minutos;
8. descorar com ácido acético a 5%.
Observação: É
possível comprar géis prontos para este procedimento
sob o nome de agarose ácida para eletroforese de hemoglobinas. |
4- Dosagem Bioquímica de Hb Fetal
Princípio
A Hb Fetal é mais resistente à desnaturação
por soluções fortemente alcalinas do que outros tipos
de hemoglobinas. O teste é realizado adicionando-se uma determinada
quantidade de solução alcalina em uma concentração
conhecida de hemolisado preparado de eritrócitos lavados
e tratados com água e clorofórmio. Após um
tempo específico, a desnaturação é bloqueada
por adição de sulfato de amônio saturado, ou
parcialmente saturado. O sulfato de amônio diminui o pH e
precipita a hemoglobina saturada. Após a filtração,
a quantidade de hemoglobina inalterada é avaliada e expressa
como hemoglobina álcali-resistente (ou Hb Fetal) em valores
percentuais.
Equipamento
1. espectrofotômetro
2. pipetas de 1 ml, 2 ml, 5 ml, 10 ml
3. cronômetro
4. papel de filtro
5. tubos 17 X 100 mm
6. funis pequenos
Reagentes
1. Solução de Drabkin (cianeto)
K3Fe(Cn)6.....................................200mg
KCN.............................................200mg
Água destilada q.s.p....................1000ml
2. NaOH 1,2N
NaOH.........................................48g
Água destilada q.s.p..................1000ml
3. Solução saturada de sulfato de
amônio
(NH4)2SO4..................................500g
Água destilada q.s.p..................500ml
Procedimento
1. Diluir 0,6 ml da solução de hemoglobina
em um tubo contendo 10 ml da solução de Drabkin. Homogeneizar
bem por inversão.
2. Colocar 5,6 ml da solução de hemoglobina diluída
no item 1 em um tubo rotulado “Hb Fetal”. Adicionar
0,4 ml da solução NaOH 1,2 N e acionar o cronômetro.
Agitar cuidadosamente por 10 segundos.
3. Ao final de dois minutos exatos, adicionar 4 ml da solução
saturada de sulfato de amônio. Homogeneizar por inversão
e deixar em repouso por 5 a 10 minutos no máximo.
4. Filtrar o conteúdo do tubo “Hb Fetal” em papel
de filtro duplo.
5. Preparar a solução padrão, colocando em
um tubo de ensaio: 1,4 ml da solução de hemoglobina
diluída no item 1, 0,1 ml de água destilada e 1 ml
da solução saturada de sulfato de amônio. Homogeneizar
e transferir 1 ml dessa solução para outro tubo, e
juntar 9 ml de solução Drabkin. A solução
padrão é 10 vezes mais diluída do que a solução
de “Hb Fetal”.
6. Ler a DO do tubo “Hb Fetal” e do padrão em
540 nm, utilizando-se como branco a solução de Drabkin.
7. Cálculo:
% Hb Fetal =
|
DO Hb Fetal X 100 |
| _______________ |
| DO padrão X 10 |
VR: 0,0 à 2,0% para adultos normais |
5- Teste de Precipitação para Hemoglobinas
Instáveis
Princípio
As cadeias da hemoglobina (e o tetrâmero)
são estruturas altamente estáveis, e dependem da força
coletiva de quatro fatores:
1. um grande conteúdo helicóide que constitui 75%
da estrutura de cada cadeia polipeptídica;
2. o firme ligamento entre o grupo heme e o polipeptídeo
(globina);
3. a localização interna de aminoácidos não-polares
e hidrofóbicos, que mantêm o “pacote” de
proteção ao grupo heme;
4. os contatos a1b1
que estabilizam a integração entre as cadeias alfa
e beta.
A diminuição da estabilidade da hemoglobina
pode ser resultante da alteração de qualquer um dos
quatro fatores, geralmente sensíveis quando expostos ao calor.
Em um tampão apropriado, a hemoglobina normal é dificilmente
precipitada quando submetida à determinada temperatura (50
a 60°C); por um certo tempo de exposição sob as
mesmas condições, as hemoglobinas instáveis
se desnaturam e se precipitam.
Apresentaremos dois testes específicos para detectar hemoglobinas
instáveis: a) desnaturação ao calor e b) precipitação
por isopropanol.
A) TESTE DE DESNATURAÇÃO
AO CALOR
Equipamento
1. tubos de vidro 17 x 100mm e 12 x 75mm
2. pipetas de 5ml
3. centrífuga
4. banho-maria: 50 a 60°C
5. pH metro
6. balão volumétrico de 100ml
Reagentes
1. Solução fosfato monobásico
de sódio 0,1M
NaH2PO4 . H2O............................13,8g
Água destilada q.s.p....................1 litro
2. Solução de hidrogenofosfato de di-sódio
0,1M
Na2HPO4 (anidro)......................14,2g
Água destilada q.s.p..................1 litro
3. Solução tampão fosfato,
pH 7,4:
Solução de NaH2PO4 0,1M......19,2ml
Solução de Na2HPO4 0,1M......
80,8ml
4. NaCl a 0,8%
Procedimento
1. em um tubo de hemólise colocar 1ml de
sangue fresco, coletado com anticoagulante. Centrifugar a 1.500rpm
e desprezar o plasma. Lavar os eritrócitos com NaCl a 0,85%,
por duas vezes. Hemolisar os eritrócitos com 5ml de água
destilada. Homogeneizar por seis vezes;
2. transferir o hemolisado para um tubo maior e, adicionar 5ml do
tampão fosfato (pH 7,4), homogeneizar por seis vezes e centrifugar
por 10 minutos a 1.500rpm;
3. transferir 2ml do sobrenadante para outro tubo e incuba-lo a
50°C, em banho-maria, por uma hora, ou a 60°C por trinta
minutos;
4. observar se houve precipitação.
Controle
É fundamental o uso de uma amostra controle,
obtida nas mesmas condições da amostra teste.
Interpretação
Em sangue com hemoglobinas normais é possível
que ocorra discreto grau de precipitação. O resultado
é positivo quando a precipitação é floculenta
e em grande quantidade.
Precauções
1. as amostras a serem analisadas não devem
exceder 72 horas após a coleta;
2. o diagnóstico da Hb instável deve ser confirmado
por outros testes específicos: corpos de Heinz, eletroforese
de hemoglobina, dosagem de metaemoglobina;
3. a temperatura e o pH 7,4 do tampão são pontos críticos
nesse teste.
B) TESTE DE PRECIPITAÇÃO
POR ISOPROPANOL
Equipamento
1. tubos de vidro 17 x 75mm e rolha
2. pipeta de 5ml
3. micropipeta de 100m l
4. banho-maria: 37°C
5. centrífuga
6. pH metro
Reagentes
1. Solução tampão Tris/isopropanol
pH 7,4
Tris-hidroximetril-aminometano.12,11g
Isopropanol puro ....................... 170ml
Água destilada q.s.p.....................1 litro
Ajustar o pH 7,4 com HCl concentrado
Procedimento
1. colocar 100m l de
sangue + 100m l de saponina a 1% em um
tubo de hemólise. Agitar moderadamente até que se
processe a hemólise;
2. adicionar ao hemolisado, 2ml de tampão Tris/isopropanol
previamente equilibrado a 37°C. Agitar moderadamente, ou homogeneizar
por inversão, e incubar essa solução por uma
hora a 37°C;
3. observar, a cada 10 minutos, se houve precipitação.
Interpretação
A presença de Hb instável causa floculação
nos primeiros 10 minutos, seguida de precipitação.
Precauções
1. as hemoglobinas normais permanecem estáveis
durante todo o processo. Entretanto, pode ocorrer discreta precipitação
em alguns casos, após 30-45 minutos. A Hb S é mais
instável que a Hb A. A Hb A2 é a hemoglobina
mais estável entre as hemoglobinas humanas;
2. é necessário o uso de uma amostra controle, obtida
nas mesmas condições que o teste;
3. a temperatura de 37°C, o pH 7,4 do tampão e a concentração
de isopropanol são pontos críticos neste teste;
4. o diagnóstico de Hb instável deve ser confirmado
por outros testes específicos: corpos de Heinz, eletroforese
de hemoglobina, dosagem de metaemoglobina. |
6- Dosagem de Metaemoglobina por Absorção
Espectrofotométrica
Princípio
A metaemoglobina é um subproduto resultante
da transformação da oxiemoglobina. Essa transformação
é decorrente da contínua oxidação da
hemoglobina que ocorre notadamente devido ao envelhecimento e conseqüente
apoptose do eritrócito. Entretanto outros fatores podem influenciar
no aumento da concentração de metaemoglobina, por
ex.: Hb S (AS, SS, SC, SF), talassemias beta maior e menor, Hb instáveis,
Hb M, oxidações induzidas pela deficiência de
G-6PD, e oxidações “adquiridas” de medicamentos
(ex.: sulfas, nitritos, Tc), alimentos, meio ambiente poluído
(ex.: gases de NOx e SOx).
Reagentes
1 – Solução estoque de Tampão
Fosfato M/15
Na2HPO412H2O ....................................
9,0g
KH2PO4 .................................................
5,7g
H2O q.s.p. .............................................
1,0 litro
2 – Solução trabalho de Tampão
Fosfato M/60
Diluir 250 ml da solução estoque para 1 litro (q.s.p.)
de água destilada.
Obs.: Conservar as soluções estoque e trabalho em
refrigerador.
3 – Saponina a 1%.
Procedimento
Para cada análise usar dois tubos de hemólise
identificados por A e B.
Tubo A: Colocar primeiramente 100m
l de sangue total, coletado com anticoagulante e adicionar 100m
l de saponina. Agitar para ocorrer hemólise. A seguir, adicionar
6 ml do tampão Fosfato M/60. Homogeneizar por inversão.
Tubo B: Colocar 300m
l da mistura do tubo A e, a seguir, 3 ml do tampão Fosfato
M/60. Homogeneizar por inversão.
Leituras espectrofotométricas
a) Ajustar o espectrofotômetro
em comprimento de onda 630 nm, usar o tampão
Fosfato M/60 como branco e acerto do zero da absorbância,
e a seguir fazer a leitura do tubo A, anotando
o valor da densidade óptica (D.O.).
b) Ajustar o espectrofotômetro em comprimento
de onda 540 nm, usar o tampão Fosfato M/60 como
branco e acerto do zero da absorbância, e a seguir fazer a
leitura do tubo B, anotando o valor da densidade
óptica (D.O.).
Cálculo:
% DE Meta Hb =
|
D.O. 630 nm X 100 |
| ___________________________ |
| D.O. 630 nm + (D.O. 540 nm X 10) |
Obs.: O coeficiente 10 se deve
à diluição realizada no tubo B (300m
l do tubo A: 3 ml do tampão Fosfato).
Interpretação
A leitura do tubo A em 630 nm avalia a absorbância
da metaemoglobina obtida da hemólise dos eritrócitos
e diluída em solução tamponada. Por outro lado,
a leitura B, sob as mesmas condições, em 540 nm avalia
a absorbância da oxiemoglobina. Para obter sensibilidade técnica
na leitura, a solução do tubo B foi diluída
dez vezes.
Valores normais - Os valores
normais para concentração de metaemoglobina variam
de 0 a 4%. Acima de 4% se considera elevada. |
7- Pesquisa Intra-Eritrocitária de Hb H
Princípio
A Hb H é uma hemoglobina anormal cuja molécula
é formada somente por globinas beta, sendo portanto um tetrâmero
b4, diferente da Hb A que
é composta por um tetrâmero constituído por
duas globinas alfa e duas globinas beta - a2b2.
A Hb H se deve à diminuição de globinas alfa
que ocorre na talassemia alfa, por isso as globinas beta se juntam
e se tetramerizam.
Uma das formas de identificar a talassemia alfa é pesquisar
a presença de Hb H nos eritrócitos. Para pesquisa-la
é necessário induzir sua precipitação
com o corante azul de crezil brilhante.
Reagentes
Corante de Azul de Crezil Brilhante
Azul de crezil brilhante...................................... 1,0g
Citrato de sódio ................................................
0,4g
Cloreto de sódio ...............................................
0,8g
H2O q.s.p. ........................................................
100ml
Procedimento
1) Colocar em um tubo de hemólise 100m
l de sangue total com anticoagulante (EDTA, heparina, sequestrene
ou ACD) e adicionar 200m l do corante
Azul de Crezil Brilhante. Misturar com leve agitação.
2) Incubar em banho maria a 37ºC por 30 a 40 minutos.
3) Após incubação fazer o esfregaço
tradicional e pesquisar a presença de eritrócitos
com Hb H na porção fina da lâmina.
4) A presença de uma ou mais células típicas
de Hb H é indicativo da talassemia alfa.
IMPORTÂNCIA
A talassemia alfa se deve a lesão parcial
ou total de um, dois, três ou dos quatro genes alfa. Dessa
forma, observa-se que sua manifestação clínica
e laboratorial é muito heterogênea.
A forma mais comum em todo o mundo é a lesão de apenas
um gene. Neste caso é difícil encontrar a Hb H precipitada
nos eritrócitos, e na eletroforese a fração
de Hb H está abaixo de 1%. O paciente não tem anemia
devido a este tipo de talassemia alfa. A sua prevalência no
Brasil varia de 10 a 20%.
A lesão de dois genes alfa causa maior precipitação
de Hb H nos eritrócitos, é comum vê-los em todos
os campos microscópicos, e na eletroforese de hemoglobina
a fração de Hb H tem concentração entre
1 a 5%. Sua prevalência em nossa população é
cerca de 3 a 6%, e causa discreto grau de anemia microcítica
e hipocrômica.
Na lesão de três genes, as manifestações
clínicas são evidentes pela anemia e esplenomegalia,
enquanto as alterações laboratoriais apresentam anemia
microcítica e hipocrômica de grau moderado (Hb: 9 a
10,0g/dl). Na eletroforese a Hb H tem concentrações
acima de 5% (> 5% a 25%), e a pesquisa intraeritrocitária
apresenta inúmeros eritrócitos com precipitados de
Hb H. A freqüência de tal. alfa com lesão de três
genes alfa (ou doença de Hb H) é de 1:5.000 pessoas.
Por fim, a lesão de quatro genes alfa quando parciais podem
causar a doença de Hb H, mas quando as lesões são
totais, fato que não sintetiza nenhuma globina alfa, o portador
padece de hidropsia fetal, com morte fetal ou logo ao nascer, 100%
dos seus eritrócitos tem precipitados de Hb Bart’s
(similar à Hb H). No Brasil há pouquíssimos
casos relatados. É comum nas populações do
sudeste asiático.
Informações mais completas poderão ser encontradas
no capítulo 7 deste site. |
8- Teste para Avalias a Fragilidade Osmótica dos
Eritrócitos
Princípio
Todos eritrócitos normais e anormais apresentam equilíbrio
osmótico em soluções isotônicas de cloreto
de sódio (NaCl) com concentração entre 0,8
e 0,9%. Contudo, há eritrócitos com defeitos na constituição
protética da membrana que se comportam com mais fragilidade
osmótica em relação aos eritrócitos
normais. Esses eritrócitos mais frágeis hemolisam
intensamente, a partir de soluções de NaCl com concentrações
decrescentes: 0,6%, 0,5%, 0,4% e 0,3%. Para conhecer o grau de hemólise
se faz a medida da fragilidade osmótica eritrocitária,
bem como a curva de fragilidade osmótica.
Reativos
1) Solução estoque de NaCl a 10%
NaCl ................................... 9,00gr
Na2HPO4 ............................ 1,36gr
NaH2PO4H2O ......................0,27gr
H2O q.s.p. ...........................100ml
2) Soluções de NaCl com concentrações
decrescentes de 0,9 a 0,1%.
A preparação dessas soluções se faz
a partir da solução estoque de NaCl a 10%, conforme
as seguintes diluições com água em balão
volumétrico de 100ml.
| Soluções de
NaCl |
Solução de NaCl
a 10% |
Adição |
H2O destilada |
| 0,9 |
9 ml |
+ |
91 ml |
| 0,8 |
8 ml |
+ |
92 ml |
| 0,7 |
7 ml |
+ |
93 ml |
| 0,6 |
6 ml |
+ |
94 ml |
| 0,5 |
5 ml |
+ |
95 ml |
| 0,4 |
4 ml |
+ |
96 ml |
| 0,3 |
3 ml |
+ |
97 ml |
| 0,2 |
2 ml |
+ |
98 ml |
| 0,1 |
1 ml |
+ |
99 ml |
Procedimento
Sempre que for realizar o teste de fragilidade osmótica
num paciente é necessário compará-lo com outra
amostra “normal”, com sangue coletado nas mesmas condições
(mesmo anticoagulante, mesmo dia).
Para cada tubo de hemólise identificado com a devida concentração
de NaCl e os nomes dos analisados, proceder da seguinte forma:
1) 5ml de cada solução de NaCl (0,9 a 0,1%)
50m l de sangue bem homogeneizado
2) Homogeneizar os tubos por inversão (3 a 5 vezes), e deixá-los
em repouso por 10 a 15 minutos à temperatura ambiente (±
25ºC).
3) Centrifugar todos os tubos por 5 minutos em 1500 a 2000 rpm.
4) Após a centrifugação transferir, por meio
de pipeta Pasteur, o sobrenadante de cada tubo para outro correspondente
devidamente identificado com as concentrações de NaCl
e os nomes dos analisados.
5) Proceder a leitura espectrofotométrica de todos os sobrenadantes,
em comprimento de onda 540nm (ou filtro verde), da seguinte forma:
a) Usar o sobrenadante do tubo com NaCl 0,9% de
cada amostra analisada como branco (acerto do zero).
b) A partir do acerto do zero na escala de absorbância
ou densidade óptica (D.O.), fazer a leitura de cada tubo.
O valor da D.O. do sobrenadante do tubo com NaCl 0,1% corresponderá
a 100% de hemólise, e a partir desse valor se calculará
por meio de regra de três as hemólises de outros tubos.
c)
Ex:
DO NaCl 0,1% —— 100%
DO NaCl 0,2% —— X
X =
|
DO NaCl 0,2% x 100 |
| ________________ |
| DO NaCl 0,1% |
| % NaCl |
% Lise Normal |
% Lise na esferocitose |
| 0,1 |
100 |
100 |
| 0,2 |
99 — 100 |
100 |
| 0,3 |
90 — 100 |
100 |
| 0,4 |
50 — 90 |
90 — 100 |
| 0,5 |
0 — 6 |
20 — 80 |
| 0,6 |
0 |
0 — 10 |
| 0,7 |
0 |
0 |
| 0,8 |
0 |
0 |
|
CURVA DE FRAGILIDADE OSMÓTICA
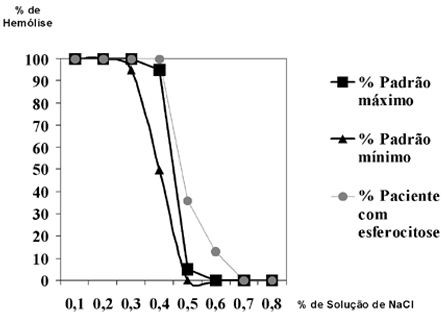
|
MÉTODOS DE AVALIAÇÃO LABORATORIAL
Apresentamos aqui um resumo dos principais métodos bioquímicos usados em análises laboratoriais. Texto do curso de Pós Gradução Lato Sensu em Análises Clínicas.
|
|

