| Autor: | Paulo Cesar Naoum | |
| Flávio Augusto Naoum |
| Introdução | ||||||||||||
As
hemoglobinas instáveis constituem um grupo de variantes genéticas
de hemoglobinas em que a mutação de aminoácidos
nas globinas alfa ou beta afeta a estrutura da molécula tornando-a
instável. A avaliação da estabilidade da molécula
de hemoglobina é realizada por métodos físico-químicos
bem definidos atualmente, entre os quais destacam-se o aquecimento
da solução de hemolisado entre 50 e 60°C, a incubação
com isopropanol (HCl) a 37°C, ou a agitação vigorosa
do tubo contendo o hemolisado. Assim, as hemoglobinas que precipitam
mais rapidamente do que as normais são designadas instáveis. Devido à grande diversidade dos pontos de mutações na estrutura globínica, bem como os tipos de mutações por substituições e deleções de aminoácidos, as formas de instabilização se apresentam muito variadas. Devido a Por essa razão, algumas hemoglobinas são discretamente instáveis e não estão associadas com sintomas clínicos, enquanto outras hemoglobinas instáveis se precipitam com grande intensidade, causando anemias hemolíticas. Essas anemias podem ser graves, com acentuada diminuição dos níveis de hemoglobina e reticulocitose muito elevada, ou, então, podem apresentar-se com discreto quadro hemolítico acompanhado por modesta reticulocitose. Uma das principais características das hemoglobinas instáveis que causam anemia hemolítica é a presença de corpos de inclusões eritrocitários conhecidos por corpos de Heinz. Os corpos de Heinz normalmente não são visualizados nos eritrócitos circulantes, a não ser que o portador tenha sido esplenectomizado, mas podem ser detectados quando os eritrócitos são incubados com corantes indutores, por exemplo, azul de cresil brilhante. Em geral, o grau de instabilidade da hemoglobina instável está relacionado com a produção de corpos de Heinz e com a gravidade da anemia. Desde 1964, quando Grimes, Meisler e Dacie descreveram a primeira hemoglobina instável, cerca de 200 variantes diferentes foram estruturalmente caracterizadas, muitas das quais causadas por mutações recentes, ou “fresh mutations”, sem apresentarem história familiar. No Brasil o aparecimento de hemoglobinas instáveis não é incomum. Vários casos foram registrados em São Paulo, Rio Grande do Sul, Rio de Janeiro, Santa Catarina e em Manaus. Em nosso laboratório diagnosticamos 18 casos, dos quais cinco foram identificados como Hb Koln, além de vários outros tipo: Hb Niterói, Hb Sant’Anna, Hb Hasharon, Hb Meinz, etc.
A estrutura tetramerizada da molécula
de hemoglobina se mantém estável por meio de importantes
ligações efetuadas por aminoácidos. Um desses
pontos de contato corre entre as globinas dos tipos alfa e beta,
ou a1b1.
Outro ponto de estabilização química é
verificado na superfície interna da hemoglobina, e é
exercido, notadamente, pelos aminoácidos que protegem o
grupo heme da oxidação. Por outro lado, a própria
estrutura tridimensional da hemoglobina, com forma helicóide,
estabelece a configuração globular da hemoglobina
e mantém os equilíbrios funcional e estrutural entre
seus aminoácidos formadores. A substituição
de qualquer um desses resíduos, pertencentes a um dos três
pontos estabilizadores, por outro de características físicoquímicas
diferentes, por exemplo: tamanho, ponto isoelétrico e polaridade
impossibilitará a manutenção da integridade
molecular. Essa desestabilização ocorrerá,
inicialmente, pelo afrouxamento da sua estrutura, permitindo o
acesso de água para o inteior do grupo heme, oxidando-o.
A esse processo segue-se a desintegração do tetrâmero,
cujos polipeptídeos desagregados precipitam-se no interior
dos eritrócitos sob forma de corpos de Heinz.
A hemólise eritrocitária decorrente
da formação dos corpos de Heinz é um fenômeno
oxidativo. |
||||||||||||
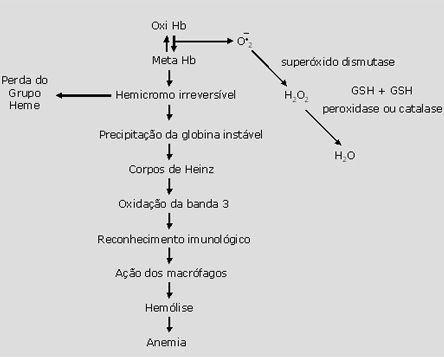
Figura 8.1: Seqüência de eventos no processo de oxidação das hemoglobinas instáveis. |
||||||||||||
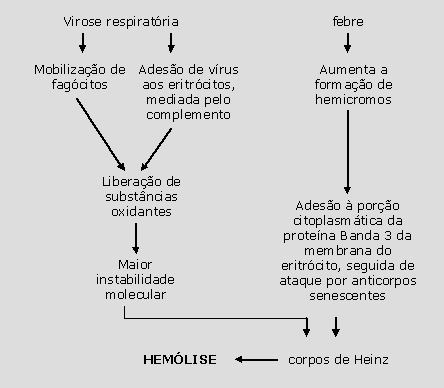
A geração de corpos de Heinz se deve, portanto, a uma série de reações oxidativas que se inicia pela transformação da oxiemoglobina em metaemoglobina. Como se sabe, uma das mais importantes funções da globina é manter o grupo heme na forma reduzida. Para efetuar esse controle, no qual a água é totalmente impedida de penetrar no interior do grupo heme e, assim, não atingir o ferro, ocorre uma conformação estrutural do aminoácido que resulta no chamado “pacote de proteção do grupo heme” ou, simplesmente, “pacote do heme”. Dessa forma, mantém-se o ferro no estado ferroso (Fe+ + ou Hb+ +O2- - ). A maioria das hemoglobinas instáveis tem propensão a se autoxidar em metaemoglobina, o que representa um valor de três a quatro vezes maior do que a Hb A. A formação de metaemoglobina envolve a transferência de elétrons do ferro do grupo heme, com liberação de radicais superóxidos: |
||||||||||||
Fe+ + ou Hb+ +O2- - ® Hb+ + + + O2- |
||||||||||||
Quando o grau de formação de metaemoglobina aumenta, como no caso das hemoglobinas instáveis, a metaemoglobina redutase não consegue reverter a situação, desfazendo o equilíbrio entre oxiHb e metaHb (figura 8.1). Como conseqüência desse desequilíbrio, a metaemoglobia origina subprodutos conhecidos por hemicromos e perde o grupo heme. Esses subprodutos de globinas instáveis e desprovidas do grupo heme se precipitam nos eritrócitos, sob forma de corpos de Heinz (figura 8.2). Os corpos de Heinz exercem efeitos deletérios às proteínas de membranas dos eritrócitos, causando oxidação da banda 3, fato que permite o reconhecimento imunológico pelos macrófagos do sistema retículo-endotelial do baço. A ação dos macrófagos, ao retirar por fagocitose os corpos de Heinz causa a deformação dos eritrócitos, resultando as células “mordidas”, (figura 8.3), com conseqüente hemólise e anemia. |
||||||||||||
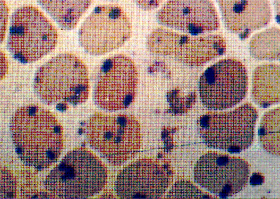
Figura 8.2: Eritrócitos com precipitados de corpos de Heinz em pessoa esplenectomizada com hemoglobina instável do tipo Koln. |
||||||||||||

Figura 8.3: “Célula mordida” no sangue periférico de um portador de hemoglobina instável. |
||||||||||||
Oxidações e mecanismos de hemólise Alguns trabalhos realizados com hemoglobinas
instáveis demonstraram que a liberação do
ferro, no processo de degradação da molécula
de hemoglobina, contribui para estimular mais reações
oxidativas. Na auto-oxidação das hemoglobinas instáveis
ocorre a contínua geração de íons
superóxidos e, consequentemente, aumenta a requisição
de enzimas redutoras para equilibrar as atividades de oxidação-redução.
O efeito quase imediato à ação oxidativa
resulta no aumento da concentração das enzimas nicotinamida-adenina-dinucleotídeo-reduzida
(NADH); nicotinamida-adenina-dinucleotídeo-fosfato-reduzida
(NADPH), da metaemoglobina redutase, catalase, glutationa peroxidase
e superóxido dismutase. Obviamente, o processo oxidativo
nas hemoglobinas instáveis sobrepõe as reações
das enzimas redutoras, apesar de estas estarem permanentes com
seus processos de sínteses elevados em comparação
as de eritrócitos com hemoglobinas normais. |
||||||||||||
|
||||||||||||
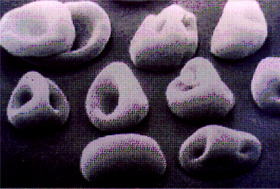
Figura 8.4: Fotomicrografia eletrônica de eritrócitos marcados por macrófagos. Observar as lesões de membranas causadas pela agregação de corpos de Heinz. |
||||||||||||
Características gerais das hemoglobinas instáveis A principal evidência laboratorial das
hemoglobinas instáveis é sua reduzida estabilidade
quando submetidas ao calor de 50 a 60ºC. Particularmente,
a mudança que reduz os contatos entre as subunidades que
compõem a hemoglobina produzirá sua instabilidade.
Exemplos importantes são a Hb E e a Hb S que dão
reações discretamente positivas ao serem submetidas
aos testes de calor e ao isopropanol. Apesar de essas hemoglobinas
terem um pequeno grau de instabilidade, o termo hemoglobinas instáveis
deverá ser reservado àquelas hemoglobinas que produzem
corpos de inclusões de Heinz em pacientes com anemias hemolíticas
agudas ou crônicas.
As técnicas específicas mais
sensíveis para o diagnóstico laboratorial desse
grupo de hemoglobinas anormais são as seguintes: |
||||||||||||
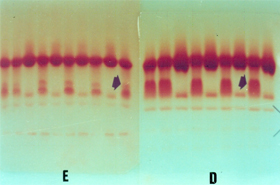
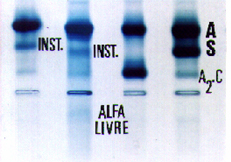
Figura 8.5: Eletroforese alcalina (pH 8,5) em acetato de celulose de uma família com hemoglobina instável. A imagem da esquerda mostra hemolisados preparados com saponina a 1%. A imagem da direita, na mesma seqüência de aplicação, mostra as hemoglobinas obtidas de solução de hemoglobina preparada com clorofórmio. As setas indicam a região da hemoglobina instável. |
||||||||||||
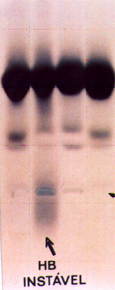
Figura 8.6: Eletroforese alcalina (pH 8,5) em acetato de celulose. Da esquerda para a direita: Hb AA, Hb A + Hb Instável com cadeia alfa livre, obtida de hemolisado com saponina a 1%; Hb A + Hb Instável obtida de extração com clorofórmio; e Hb AA. A única similaridade entre as duas hemoglobinas instáveis é a posição de Hb A2, um pouco adiante de Hb A2 normal. |
||||||||||||
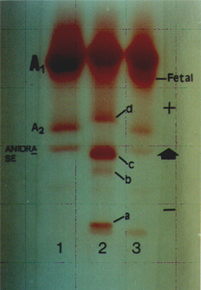
Figura 8.7: Eletroforese alcalina (pH 8,5) em acetato de celulose. (1) Hb AA; (2) Hb A + Instável com polímeros lentos: a, b, c e a posição da Hb A2 alterada (d); (3) Hb A + Fetal elevada. |
||||||||||||
Outras informações: Cerca de 35% das hemoglobinas instáveis apresentam alterações na afinidade ao oxigênio, sempre associada à anemia. O aumento de glicose-6-fosfato desidrogenase (G-6-PD)tem sido relatado em 12% dos portadores desse tipo de hemoglobinopatia. O aumento da fragilidade osmótica eritrocitária ocorre em pelo menos 5% desses pacientes.
Os sinais e sintomas clínicos acompanham
o grau de instabilidade da molécula, ou seja, as hemoglobinas
levemente instáveis são assintomáticas, e
as bastante instáveis produzem o quadro de anemia hemolítica
grave. O início da doença depende, porém,
do tipo de globina afetada: as de globinas alfa ou gama têm
início no período neonatal e as de globina beta
somente após 3 a 4 meses de vida. Nesta ocasião
podem desaparecer os sintomas causados pela anormalidade na globina
gama, devido à sua substituição pela beta.
Outro fator que pode influenciar a clínica é o grau
de afinidade da hemoglobina ao oxigênio: a hemoglobina instável
pode possuir afinidade com redução do P50,
ocasionando poliglobulia, ou baixa afinidade com elevação
do P50, e resultando em cianose por formação
da metaemoglobina. A poliglobulia associada à hemólise
compensada pode elevar os níveis de hemoglobinas do paciente
próximo ao limite superior da faixa normal. |
||||||||||||
 |
||||||||||||
Têm sido relatadas também as “crises aplásticas”. Nas variantes muito instáveis, o quadro de anemia hemolítica crônica acha-se completamente instalado no fim do primeiro ano de vida com icterícia, esplenomegalia, palidez e alguns casos com eliminação de urina escura pela excreção de dipirróis derivados dos corpos de Heinz, além de cianose causada pela presença de metaemoglobina (tabela 8.3). |
||||||||||||
Tabela 8.3: Características clínicas dos portadores de hemoglobinas instáveis. |
||||||||||||
|
||||||||||||
Outros achados incluem colelitíase, alterações ósseas e retardo do crescimento, podendo-se assemelhar à talassemia beta homozigota, com eritropoiese ineficaz. Diante de um quadro de anemia hemolítica hereditária não-esferocítica com hipocromia e reticulocitose desproporcional, deve-se suspeitar de hemoglobina instável. A herança sendo autossômica dominante evidencia-se a doença nos heterozigotos. São descritas interações com a talassemia beta, Hb Lepore, Hb S, Hb C, entre duas Hb instáveis, e adquirida após doença mieloproliferativa (Policitemia vera). O tratamento baseia-se na prevenção de uso de drogas oxidantes e de infecções, e pela administração de ácido fólico em doses baixas (3mg/dia). As transfusões de concentrado globular podem ser necessárias constantemente nas formas graves, levando às complicações e aos riscos inerentes. Quelantes de ferro podem ser tentados para o controle do acúmulo de ferro. A esplenectomia poderá ser útil, mas nem todos os casos dela se beneficiam. Nas variantes com alta afinidade da hemoglobina pelo oxigênio, há registro de mortes por tromboembolia secundária a uma eritrocitose compensatória exagerada pós-esplenectomia, associada à hemólise e plaquetose. Nestes pacientes ela deve, portanto, ser evitada. Se indicada, deve-se realiza-la após o sexto ano de vida, promovendo a vacinação antipneumocócica prévia e a profilaxia penicilínica após a idade adulta, devido à alta incidência de septicemia por germes encapsulados. A colecistectomia poderá, também, ser necessária. O prognóstico das hemoglobinas instáveis geralmente é benigno. |
||||||||||||